I. Composition
A) Les molécules amphiphiles
La molécule amphiphile peut être aussi appelée tensioactifs. Ceux-ci sont composés de deux parties :
-Tout d’abord, d’une tête polaire que l'on nomme "d'hydrophile " soluble dans l’eau. La tête polaire sera en contact avec l’eau contenue dans la surface de la bulle de savon.
- La tête polaire hydrophile est suivie d’une chaîne contenant 10 à 20 atomes de carbone que l’on peut appeler d’hydrophobe car ils sont repoussés par l’eau.

Les tensios actifs contenus dans le savon ou le liquide vaisselle permettent donc de diminunier la tension superficielle du liquide.
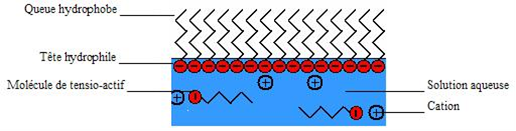
L’eau contient aussi des tensios actifs, mais pas assez pourpermettre à la bulle de durer. Dans un liquide aqueux, les tensios actifs contenus dans l’eau se trouvent a sa surface, une extremité est repoussée par l’eau (chaîne carbonnée hydrophobe), et l’autre est attirée (tête polaire hydrophile). Cette organisations des tensioactifs permet de diminuer la ension superficielle de la surface de l’eau. Leur disposition dans l’eau peut se shématiser de la manière suivante :

Cependant, par manque de place à la surface de l’eau, les tensios actifs restat dans l’eau se regroupent pour former de minuscules bulles d’aires à peine perceptible à l’œil nu (groupement de molécules). Les molécules amphiphiles sont donc disposées de la manière suivante :
B) Spécificité du savon et de ces molécules
-L’eau est formée des molécules H2O, elle possède une forte attraction à l’état liquide. Cela est dû aux molécules qui la compose, car l’oxygene a un pôle assez électronégatif, et les atomes d’oxygènes, eux, on un pôle electronégatifs, ce qui fait que les atomes s’attirent en permanence et forment des liaisons resistantes qui assurent la cohésion du liquide à l’echelle microscopique.
De manière concrète, cela explique pourquoi lorsque l’on renverse un verre d’eau sur une paroie, celle-ci forme des goutelettes au lieu de s’étaler et de former un film aqueux sur la paroie. A cause de la tension élevée de l’eau, elle cherche à avoir une surface minimale au contact de l’air.
On peut y remedier en y ajoutant du savon ou du liquide vaisselle. En effet, les tensioactifs composant ce liquide vont diminuer les forces présentes entre les atomes d’oxygène et d’hydrogène, la tension superficielle du liquide diminuera et l’eau sera donc plus apte a s’étaler sans se casser même au contact de l’aire.
-Le savon, en plus de diminuer la tension superficielle de l’eau, il possède la capacité de laver ou nettoyer que ce soit ses mains, une surface sale… Cette particularité est encore dûe aux molécules amphiphiles. En effet, en repprenant ce shéma, on en déduit que dans une solution savoneuse, les tête hydrophiles seront en contact avec l’eau, et les queues hydrophobes, avec l’air.
Mais en cas de saletées, les queus hydrophobes seront en contact avec la saletée et les tête hydophiles engloberont celle-ci, on représente ce fait avec le shéma ci dessous :

C’est donc cette différence entre la tête hydrophile et la queue hydrophobe qui donne au savon la particularité de nettoyage.
